BioTech ist das Schwerpunktthema des aktuellen Jahresberichts. Die aktuellen Forschungsaktivitäten reichen von der automatisierten Herstellung von In-vitro- und In-vivo-Diagnostika, über die Entwicklung von Materialien z. B. für die lebensrettende Erstversorgung von stark blutenden Wunden nach schweren Verletzungen bis hin zu neuen Verfahren für eine standardisierte und validierte Herstellung von unterschiedlichen humanen Gewebemodellen. Diese und noch eine Reihe anderer Beispiele aus unserer Bio-Forschung finden Sie nachfolgend in diesem Jahresbericht.
Projekte aus dem Bereich Biotechnologie
Beispiele aus der aktuellen Forschung
»AutoProNano«
»AutoProNano«: Internationale Kooperation für In-vitro- und In-vivo-Diagnostik

Das Kooperationsprojekt »AutoProNano« entwickelt einen automatisierten Prozess zur Herstellung von Nanopartikeln für In-vitro- und In-vivo-Diagnostik. Durch die Zusammenarbeit des Fraunhofer-Institut für Silicatforschung ISC mit weiteren deutschen und französischen Partnern wird die Laborautomatisierung vorangetrieben.
Biofunktionalisierten Nanodiagnostika und -therapeutika wird eine geradezu revolutionäre Rolle bei der künftigen Bekämpfung schwerer Krankheiten wie Krebs vorausgesagt. Und in der Biomedizin steigt die Nachfrage nach funktionalen Nanopartikeln mit speziellen optischen oder magnetischen Eigenschaften sowie biofunktionalen Oberflächen zur Erkennung von Antigenen und zur Wirkstofftransport.
Allerdings müssen diese Nanopartikel strenge Anforderungen erfüllen, um als Medizinprodukte zugelassen werden zu können. Eine entscheidende Herausforderung besteht darin, dass die gewünschten Eigenschaften der Nanopartikel zuverlässig reproduzierbar sind. Dafür ist ein robuster und präziser Produktionsprozess erforderlich, der internationalen Standards entspricht und skalierbar, kostengünstig und jederzeit kontrollierbar ist, um eine herausragende Qualität zu gewährleisten.
Im Rahmen des deutsch-französischen Kooperationsprojektes »AutoProNano« arbeitet das Fraunhofer-Institut für Silicatforschung ISC gemeinsam mit weiteren deutschen Partnern, wie der Technischen Hochschule Würzburg-Schweinfurt THWS, der nanoPET Pharma GmbH, dem Institut für Medizintechnik (IMES) dem Anlagenbauer Goldfuß engineering GmbH sowie den französischen Partnern Cordouan Technologies und Poly-Dtech an der Entwicklung eines anpassungsfähigen, automatisierten Prozesses zur Herstellung und Analyse von diagnostisch relevanten Nanopartikelsystemen.
Ziel des Projekts ist es, einen flexiblen, robotergesteuerten Prozess zur automatisierten Herstellung und Charakterisierung von diagnostischen Nanopartikeln für die In-vitro- und In-vivo-Diagnostik zu etablieren.
Das Fraunhofer ISC und Goldfuß engineering haben bereits im Rahmen des vom Bundesministerium für Bildung und Forschung (BMBF) geförderten Verbundprojekts APRONA das Grundprinzip einer Roboterplattform zur automatisierten Herstellung von Nanopartikeln entwickelt. Im Rahmen von AutoProNano wird diese Plattform nun weiterentwickelt, um wesentliche Syntheseprozesse automatisiert durchzuführen. Dadurch können standardisierte Produktqualitäten sichergestellt und relevante Qualitätsanforderungen bereits in der Entwicklungsphase berücksichtigt werden.
Das deutsch-französische Kooperationsprojekt AutoProNano hat ein Gesamtvolumen von 1,5 Millionen Euro. Die deutschen Partner erhalten ihre Förderung im Rahmen des ZIM-Programms des BMWK, während die französischen Partner von der Bpifrance gefördert werden. Durch diese internationale Zusammenarbeit wird ein wichtiger Schritt in Richtung hochmoderne Diagnostik und medizinischer Fortschritt gemacht.
»CoSiMa«
»CoSiMa«: Innovative Anti-Aging-Gesichtsmaske zur Stimulation des Bindegewebsaufbaus

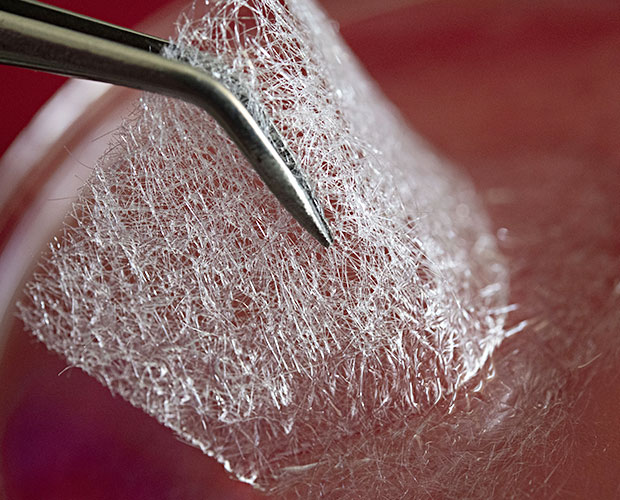
Was die Zusammenarbeit des Fraunhofer-Instituts für Silicatforschung ISC mit der Kosmetikindustrie hervorbringen kann, zeigt das Projekt CoSiMa. Gemeinsam mit ihrem Projektpartner, der B-COS GmbH, entwickelte ein Forscherteam der Abteilung Biomaterialien eine Anti-Aging-Gesichtsmaske, die Orthokieselsäure freisetzt. Aus dem Projekt entstand nicht nur viel neues Knowhow auf dem Gebiet der Sol-Gel-Verfahren, auch eine Vermarktung der Maske ist geplant.
Orthokieselsäure (OKS) stimuliert die Kollagenproduktion in der Lederhaut. Im Gegensatz zu herkömmlichen Kosmetikprodukten werden ungeliebte Hautfalten also nicht kurzfristig aufgepolstert, sondern langfristig gefüllt. Auch der körpereigene Bindegewebsaufbau wird angeregt, was die Faltenbildung generell reduziert. Diesen Effekt machte sich das Forscherteam des Fraunhofer-Instituts für Silicatforschung ISC in Zusammenarbeit mit ihrem Projektpartner zu Nutze.
Ziel des Projekts CoSiMa war die Entwicklung einer Gesichtsmaske, die sich in Kontakt mit einer Aktivierungslösung innerhalb eines kurzen Anwendungszeitraums rückstandslos zu Orthokieselsäure auflöst und über deren Aufnahme in die Haut einen Anti-Aging-Effekt erzielt.
Aufnahme von OKS in Haut in vitro nachgewiesen
Nach zweieinhalb Jahren Laufzeit konnte das Team das Projekt im November 2022 erfolgreich abschließen und eine vielversprechende Demoversion der Gesichtsmaske entwickeln. Die Demo-Maske besteht aus zwei Komponenten: einem Kieselgelfaservlies und einer Aktivierungslösung. Sie lässt sich innerhalb von drei bis fünf Minuten nahezu rückstandsfrei in die Haut einmassieren. Es konnte nachgewiesen werden, dass die Orthokieselsäure auch tatsächlich in die obere Hautschicht aufgenommen wird. Ob auch die gewünschte Hautregeneration auftritt, wird noch dermatologisch getestet.
Kieselgelfaservlies als Grundlage
Für die Grundlage der Maske griffen die Forschenden auf ein als Medizinprodukt zugelassenes Kieselgelfaservlies zurück, das seit 2010 zur Regeneration chronischer Wunden zugelassen ist. Bei einer Gesichtsmaske muss die Hydrolyse, also die Auflösung der wasserlöslichen OKS jedoch schneller ablaufen als bei der Versorgung chronischer Wunden
Dafür wurden zur Variation der Matrix des Kieselgelvlieses die Synthese- und Prozessparameter modifiziert sowie die Wirkung der Zugabe von verschiedenen Substanzen getestet. Eine Herausforderung dabei war es, die Auflösung zum genau richtigen Zeitpunkt zu ermöglichen. Es gelang den Forschenden, eine Kombination aus Lagerstabilität und Aktivierungstrigger zu finden, die die Kieselgelmaske innerhalb der gewünschten Zeit soweit auflöst, dass die Maske leicht in die Haut einmassiert werden kann. Insgesamt konnte durch das Projekt viel neues Knowhow auf dem Gebiet Sol-Gel-basierter Materialien erarbeitet werden.
Markteintritt in Planung
Mit dem Projekt war die Abteilung Biomaterialien am Fraunhofer ISC erstmalig an der Materialentwicklung für Kosmetikprodukte beteiligt. Die dabei entstandene Vernetzung mit der Kosmetikbranche eröffnet den Weg für neue Kooperationen zwischen dem Fraunhofer ISC und der Kosmetikindustrie. Das Fraunhofer ISC und B-COS sehen gute Aussichten für die Überführung der Maske in ein marktreifes Produkt. Dafür soll die Maske noch an einem anerkannten Testinstitut für Hautpflegeprodukte getestet werden. Weitere Gespräche und Planungen für den Markttransfer sind im Gange.
»SAPs4Tissues«
»SAPs4Tissues«: menschliche Gewebemodelle mit maßgeschneiderten Biomaterialien

Menschliche Gewebemodelle statt Tierversuche?
Was für manche Fragestellungen schon möglich ist, steht für komplexere Zusammenhänge und Anwendungen immer noch vor größeren Hürden. In einem gemeinsamen Projekt des Max-Planck-Instituts für Polymerforschung, Mainz, und des Translationszentrums für Regenerative Therapien am Fraunhofer-Institut für Silicatforschung ISC, Würzburg, sollen wissenschaftliche Grundlagen und Biomaterialien für die standardisierte Herstellung von validen Gewebemodellen erarbeitet werden.
Die moderne Medizin setzt in der präklinischen Entwicklung von Wirkstoffen zunehmend auf dreidimensionale menschliche Gewebemodelle. Denn diese sind nicht nur ethisch unproblematischer, sondern oft auch wissenschaftlich aussagekräftiger als ein Tierversuch. Um für Testungen auf Risiko und Wirksamkeit von Medikamenten eingesetzt werden zu können, müssen diese Modellsysteme dem menschlichen Gewebe morphologisch und in Bezug auf die jeweilige Funktionalität möglichst nahekommen.
Genau hier setzt das Projekt SAPs4Tissue an: Mit Hilfe geordneter molekularer Eiweißbausteine, den sogenannten Peptidnanofibrillen (SAPs), werden in Kombination mit biologischen Polymeren physiologische Umgebungsbedingungen der Zelle simuliert. Die menschlichen Zellen sehen sozusagen ihr »natürliches Umfeld«, die sogenannte extrazelluläre Matrix, eine weiche Biopolymermatrix, die sie umgibt. Zusätzlich werden die molekularen Bausteine mit chemischen Gruppen versehen, die es erlauben, die Materialeigenschaften mit Hilfe externer Signale, wie zum Beispiel Licht oder dem pH-Wert, gezielt zu beeinflussen. Auf dieser resultierenden Gerüststruktur sollen im Rahmen der Studien menschliche Stammzellen zu spezialisierten Zellen umgewandelt und als funktionale Gewebe wie z. B. dem Darm gezüchtet werden, so die Hoffnung der Forschenden.
Dies ist durch Methoden des sogenannten »Tissue Engineerings« möglich, ein interdisziplinäres Arbeitsgebiet, das Prinzipien aus dem Ingenieurwesen und der Biowissenschaft zur gezielten Gewebezüchtung anwendet. Im Rahmen des Projekts werden außerdem auch die Zusammenhänge zwischen molekularer Signatur, dreidimensionaler Struktur und gewebespezifischer Funktion systematisch untersucht.
Die Projektleiter, Dr. Christopher Synatschke, Dr. Tanja Weil (MPI-Polymerforschung), Dr. Marco Metzger und Dr. Daniela Zdzieblo (Fraunhofer ISC) sind zuversichtlich, dass die Zusammenführung der Kernkompetenzen Biomaterialien, Stammzellbiologie und Tissue Engineering eine völlig neue Klasse von Gerüststrukturen hervorbringt, die den standardisierten Aufbau unterschiedlicher menschlicher Gewebe erlaubt. Ein Erfolg der Arbeit würde nicht nur die Grundlagenforschung im Bereich der Gewebe- und Krankheitsentstehung weiter beflügeln, sondern hätte auch eine erhebliche sozio-ökonomische Relevanz durch den Ersatz von Tierversuchen und durch effektivere präklinische Prüfverfahren, die sich unmittelbar positiv bei den Kosten für das Gesundheitssystem bemerkbar machen.
Das Projekt SAPs4Tissue wird von der Fraunhofer-Gesellschaft und der Max-Planck-Gesellschaft gefördert.
»TraumaCare«
»TraumaCare«: Erstversorgung stark blutender Wunden

Eine einzelne, schwer verletzte Person zu versorgen, ist schon in einem zivilen Umfeld eine Herausforderung. Bei Terroranschlägen, militärischen Konflikten oder Katastrophen erschwert die große Anzahl verletzter Personen die Versorgungslage zusätzlich. Doch die Erstversorgung ist oft entscheidend für das Überleben der Verletzten, die meist nicht an ihren Verletzungen sterben, sondern schlichtweg verbluten. Im Forschungsprojekt TraumaCare hat das Fraunhofer ISC gemeinsam mit dem Bundeswehrkrankenhaus Ulm eine Lösung entwickelt, die es Ersthelfern ermöglicht, stark blutende Wunden zu versorgen, bis eine professionelle medizinische Versorgung möglich ist.
Bei einer kriegerischen Auseinandersetzung, in Krisensituationen wie bei terroristischen Anschlägen, aber auch nach Unfällen oder bei Katastrophen ist schnelle und effektive Erste Hilfe aufgrund der großen Anzahl an Verletzten oft eine große Herausforderung. Insbesondere stark blutende Wunden stellen eine akute Gefahr für das Überleben der Betroffenen dar. Häufig versterben Opfer aufgrund unkontrollierbarer Blutungen noch vor Ort, bevor sie in einer Klinik versorgt werden können. Um diese lebensbedrohlichen Situationen besser bewältigen zu können, wurde das Forschungsprojekt TraumaCare ins Leben gerufen. Das Projekt widmet sich der Entwicklung einer Wundpaste, die von Ersthelfern leicht appliziert werden kann, um Blutungen zu stoppen und die Wunde bis zur professionellen chirurgischen Versorgung in einer Klinik zu verschließen. Dort kann die Paste im Ganzen und ohne Gewebsschädigung wieder entfernt werden.
Derzeitige Methoden zur Erstversorgung von stark blutenden Wunden umfassen unter anderem mechanische Ligaturen, hämostypische, d. h. blutstillende Verbände und Gewebe-Klebstoffe. Diese haben jedoch oft ihre Grenzen, beispielsweise in Bezug auf die Anwendbarkeit an bestimmten Körperregionen, oder bergen das Risiko zusätzlicher Gewebeschäden. TraumaCare verfolgt daher einen Ansatz, der diese Nachteile überwinden soll.
Das Konzept von TraumaCare basiert auf drei einzelnen Komponenten. Erstens kommt eine quellfähige Komponente zum Einsatz, die die gesamte Wundgeometrie ausfüllt und dem Blutdruck standhält. Zweitens sorgt eine Vernetzungskomponente dafür, dass das Gesamtmaterial in einem Zeitraum von etwa einer Minute zu einer stabilen Verschlussmasse aushärtet. Schließlich sorgen Fasern für eine höhere Festigkeit der ausgehärteten Wundpaste.
In einem Proof-of-Principle-Experiment wurde das entwickelte Material an einem kanülierten Schweinehinterbein getestet. Dabei wurde das Arteriensystem des Beins mit einer rot gefärbten phosphatgepufferten Salzlösung als Blutersatz durchspült. Nachdem das Forscherteam mit einem Stichwerkzeug eine Verletzung erzeugt hatte, applizierten sie das 3-Komponentenmaterial. Nach einem kurzen, leichten Andrücken härtete die Paste schnell aus und der Wundverschluss erfolgte. Das Material konnte anschließend problemlos entfernt werden, ohne das intakte Arteriensystem zu beeinträchtigen.
Basierend auf diesen vielversprechenden Ergebnissen plant das TraumaCare-Team die Fortsetzung des Projekts in Form von TraumaCare II, das ab 2024 für weitere zwei Jahre laufen soll. In diesem nächsten Schritt wird ein Applikator entwickelt, der ein einfaches Handling und einen einfachen Transport des Materials ermöglicht. Zudem werden Standardarbeitsanweisungen (SOPs) zur Materialherstellung erstellt und geeignete Sterilisations-, Verpackungs- und Lagerungsmethoden identifiziert.
Ziel ist es, eine Zulassung als Medizinprodukt zu erhalten, um die Erstversorgungswundpaste in der Praxis einsetzen zu können.
»SUSI«
»SUSI«: Auf dem Weg zur autonomen hiPSC-Kultur


Die Forschung an humanen induzierten pluripotenten Stammzellen (hiPSCs) hat großes Potenzial für die Entwicklung von Zelltherapien, Medikamenten und die Erforschung von Krankheiten. HiPSCs entstehen zwar im Labor aus adulten Zellen, sind embryonalen Stammzellen jedoch sehr ähnlich. Allerdings ist die Herstellung großer Mengen an hiPSCs nach wie vor eine Herausforderung. Forschende des Fraunhofer-Instituts für Silicatforschung ISC haben nun einen Bioreaktor entwickelt, der eine automatisierte Langzeitkultivierung von hiPSCs ermöglicht.
Die Forschung an hiPSCs ist eines der am schnellsten wachsenden Gebiete der Biologie. Durch die Reprogrammierung von Bindegewebszellen, die relativ einfach von Erwachsenen gewonnen werden können, ergeben sich im Vergleich zur Nutzung von embryonalen Stammzellen wesentlich weniger ethische Probleme. Gleichzeitig können die Verfügbarkeit und Vergleichbarkeit erhöht werden. Bisher ist es jedoch schwierig, solche reprogrammierten Zellen in ausreichender Menge und Qualität bereitzustellen.
Bioreaktor ermöglicht Langzeitkultivierung
Um den wachsenden Bedarf zu decken und die standardisierte Herstellung in größerer Zahl zu ermöglichen, sind neuartige Lösungen erforderlich. Ein Forscherteam des Fraunhofer-Instituts für Silicatforschung ISC hat einen dynamischen Inkubator und Suspensions-Bioreaktor entwickelt, der sich für die Langzeitkultivierung von hiPSCs eignet. Ein Fluidkreislauf, der durch eine Verschaltung von vier Ventilen ermöglicht wird, transportiert alle flüssigen Lösungen, die für die Prozesse erforderlich sind, in einer sterilen Umgebung. So können die hiPSCs vollautomatisch vermehrt und die Einflüsse menschlicher Interaktionen minimiert werden.
Entwicklung neuer Zelltherapien und Medikamente
Durch die aus dem Projekt gewonnenen Daten konnte das System so angepasst werden, dass auch verschiedene Differenzierungen aus diesen Kulturen möglich sind. Auf diese Weise trägt SUSI zum Fortschritt der hiPSC-Technologie bei, die den Zugang zu vielen menschlichen In-vitro-Modellen für die Entwicklung neuer Zelltherapien und Medikamente ermöglichen wird.
»TigerShark Science«
»TigerShark Science«: Hautorganoide aus menschlichen Stammzellen als Alternative zu Tierversuchen

Tierversuche sind seit langer Zeit ein fester Bestandteil der medizinischen und pharmazeutischen Forschung, doch es gibt immer mehr nicht nur ethische Bedenken gegenüber dieser Methode. Das Start-up-Projekt TigerShark Science hat es sich zur Aufgabe gemacht, Alternativen zu Tierversuchen in der Pharma- und Kosmetikindustrie voranzutreiben. Dafür hat das Projekt erfolgreich ein Hautorganoid aus menschlichen Stammzellen weiterentwickelt, das in Zukunft Tierversuche ersetzen könnte.
Organoide sind kleine im Labor gezüchtete Zellaggregate, die dazu dienen, realitätsnahe Organe nachzubilden. Sie ermöglichen es, physiologische Prozesse von menschlichen Organen unter kontrollierten Bedingungen zu erforschen und können somit einen wichtigen Beitrag zur medizinischen und pharmazeutischen Forschung leisten. Dem Forscherteam von TigerShark Science ist es nun gelungen ein Hautmodell zu entwickeln, das nahezu alle Strukturen der menschlichen Haut generieren kann und somit ein realitätsnahes Hautmodell darstellt - eine bedeutende Weiterentwicklung auf diesem Gebiet.
Voll funktionsfähige künstliche Haut mit Nerven, Gefäßen und Haaren gezüchtet
Das Hautmodell von TigerShark Science wird aus programmierten hiPS-Zellen entwickelt und bildet komplexe Strukturen wie Haare oder Nerven aus. Basierend auf einem Tissue-Engineering-Ansatz werden dreidimensionale Mini-Versionen menschlicher Haut in vitro hergestellt. Dadurch eignet es sich nicht nur für eine breite Palette an Anwendungsmöglichkeiten, es gibt noch eine weitere Besonderheit: Statt tierisches Kollagen für die Entwicklung zu nutzen, wird die Matrix von den humanen Zellen selbst hergestellt. Das Hautmodell soll vor allem der Erforschung von Krankheiten dienen. So wird es möglich, Hautkrankheitsmodelle in vitro herzustellen, die z. B. Hautkrebs oder Hautfibrose imitieren, um daran Krankheitsverlauf, Medikamentenwirkung oder Organentwicklung zu untersuchen.
Alternative zu Tierversuchen
Tierversuche für kosmetische Produkte sind in der EU seit einigen Jahren verboten und auch für medizinische Zwecke nur unter triftigen Gründen erlaubt. Die Verwendung von In-vitro-Testsystemen könnte somit nicht nur ethische Bedenken aus der Welt schaffen, sondern auch gesetzliche Vorgaben erfüllen und den Weg für eine fortschrittliche Forschung ebnen.
Daneben sind Tierversuche oft auch teuer und zeitaufwändig. Mit humanen Zellkulturen können Forscher schnellere und präzisere Ergebnisse erzielen, die in vielen Fällen auch besser auf den Menschen übertragbar sind. Das Hautorganoid aus menschlichen Stammzellen von TigerShark ist somit eine wegweisende Technologie, die das Potenzial hat, die Forschung zu revolutionieren.
Ausgründung des Start-Ups im nächsten Jahr geplant
Amelie Reigl, Dr. Dieter Groneberg und Dr. Florian Gröber-Becker konnten mit ihrer Start-Up-Idee die Jury von AHEAD überzeugen und befinden sich mittlerweile in Phase 2 des Programms. Damit hat TigerShark Science einen wichtigen Meilenstein erreicht und geht nun den nächsten Schritt. Das Team arbeitet nun daran, das Start-up auszugründen und die Technologie zur Züchtung menschlicher Haut auf den Markt zu bringen. Da es komplexe Hautmodelle so bisher noch nicht auf dem Markt gibt, hat die Ausgründung großes Potenzial.
Weitere Informationen
»TOPS«
»TOPS«: Faservlies minimiert Infektionsrisiko bei Endo-Exo-Prothesen
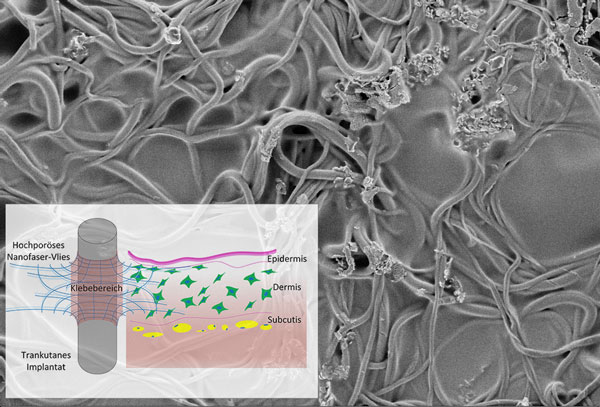

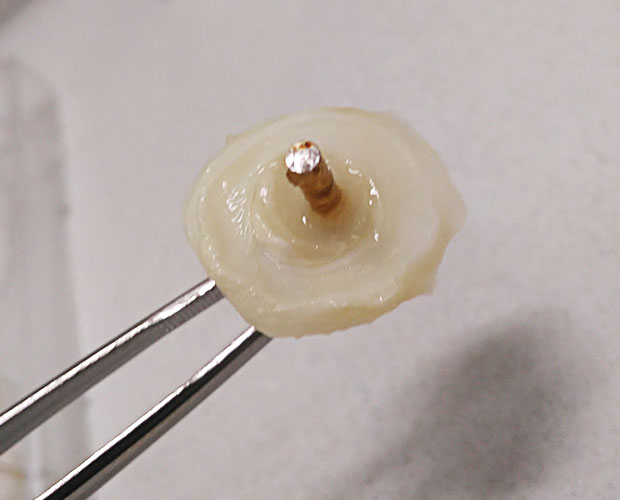
Forschende des Fraunhofer ISC haben ein neuartiges Faservlies entwickelt, das eine kovalente Verbindung zwischen Haut und Metallsockel von Endo-Exo-Prothesen herstellen kann. Dadurch werden das Infektionsrisiko minimiert und Dauerwunden vermieden. Zukünftige Projekte sollen die Klebungen weiter optimieren und das Faservlies für verschiedene Anwendungsbereiche anpassen.
Amputationen stellen für Betroffene einen erheblichen Einschnitt in die Lebensqualität dar. Der »Standard« zum Ausgleich des Funktionsverlustes sind schaftgeführte Prothesen, die meist mittels Riemen, Haftreibung oder Vakuumsuspension in Position gehalten werden. Doch trotz der mittlerweile fortgeschrittenen Technik bleiben für den Anwender häufig Probleme bestehen. Hautirritationen oder ein unphysiologischer Bewegungsablauf können Gründe dafür sein, dass auf Gehen und Stehen letztendlich lieber verzichtet wird. Alternativen können sogenannte »transkutane osseointegrierte Prothesensysteme« (TOPS) schaffen. Bei diesen Endo-Exo-Prothesen wird ein stabiler Metallsockel fest im Körper implantiert, die Prothese kann von außen angebracht werden. Eine solche Endo-Exo-Prothese geht also wortwörtlich durch die Haut.
Infektionsrisiko als Nachteil der Endo-Exo-Prothese minimiert
Für Menschen mit Beinamputationen haben solche Prothesen viele Vorteile: kein Schwitzen, weniger Hautreizungen, kein Verrutschen oder aufwendiges Anziehen, dafür mehr Bewegungsfreiheit, bessere Wahrnehmung und eine verbesserte Kraftübertragung. Das bedeutet gerade für sportlich aktivere Patienten mehr Lebensqualität. Diese Endo-Exo-Prothesen haben aber auch einen großen Nachteil: Da sich die Haut nach der operativen Anbringung der Metallsockel nicht vollständig an das Metall anschließen kann, bleibt ein offener Spalt zwischen Haut und Metallsockel bestehen. Diese Dauerwunde muss fortwährend sorgfältig gepflegt werden und birgt ein ständiges Infektionsrisiko. Für dieses Problem haben Forschende im Translationszentrum für Regenerative Therapien eine Lösung gefunden: Mit modifizierten Faservliesen, die am Fraunhofer ISC entwickelt wurden, können solche Dauerwunden in Zukunft vermieden werden.
Vorklinische Tests erfolgreich durchgeführt
In Zusammenarbeit mit dem Bundeswehrkrankenhaus in Berlin wurde das biomimetische Faservlies, das bereits am ISC entwickelt wurde, angepasst und eine kovalente Verbindung zum Implantat entwickelt.
So fördert das Vlies auf der einen Seite das dauerhafte Einwachsen von Hautzellen und ermöglicht auf der anderen Seite eine feste Anbindung ans Metall. Erste Testungen an In-vitro-Hautmodellen zeigten eine sehr gute Besiedelung des Fasermaterials mit Hautzellen und die Bildung einer Epidermis über dem Vlies, die als Barriere gegenüber Krankheitserregern dient. Auch vorklinische In-vivo-Tests sind mittlerweile erfolgreich durchgeführt worden. Sie bestätigen in Planung die Kompatibilität des Vlieses mit Gewebe und Immunsystem. Als Voraussetzung für eine klinische Translation sind weitere In-vivo-Studien geplant, welche die Effektivität des gesamten transkutanen In-vivo-Studien-Implantats untersuchen.
Ausblick auf weiterführende Forschungsprojekte
Auch ein Folgeprojekt steht schon am Start: Im Projekt BARTIM (Biohybride Bakterienbarrieren für transkutane Implantate) sollen die kovalenten Verbindungen noch weiter optimiert und die Anwendbarkeit auf unterschiedliche Materialien getestet werden. Beispielsweise könnten sie auch in der Katheterversorgung von Querschnittsgelähmten, Herzunterstützungssystemen oder externen Fixateuren eingesetzt werden. Das Forscherteam möchte mit einer möglichst breiten Anwendbarkeit die Chancen für eine klinische Translation erhöhen.
»ScarCare«
»ScarCare«: Bioresorbierbare Membran für die Heilung innerer und äußerer Wunden

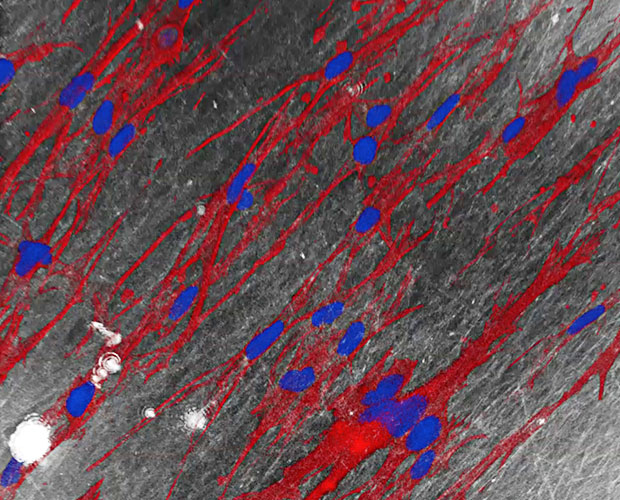
Chronische Wunden sind eine große Belastung, sowohl für Patient*innen als auch für das Gesundheitssystem. Forschende des Fraunhofer-Translationszentrums für Regenerative Therapien TLZ-RT haben eine Membran entwickelt, die die Wundversorgung einen großen Schritt weiterbringt. Denn die Membran lässt weiterhin Nährstoffe durch, was eine Grundvoraussetzung für die Wundheilung ist.
Sobald eine Wunde chronisch geworden ist, kann die Behandlung zu einer langwierigen Herausforderung werden. Besonders Menschen mit einer gestörten Wundheilung wie Diabetiker*innen sind davon betroffen. Eine nicht heilende Wunde am Fuß führt oft zu einer eingeschränkten Mobilität, was die Lebensqualität deutlich reduziert und im schlimmsten Fall bis zur Amputation führen kann.
Für das Problem bei der Versorgung chronischer Wunden ist nun eine Lösung in Sicht: Forschende des TLZ-RT am Fraunhofer-Institut für Silicatforschung ISC und des Fraunhofer-Instituts für Toxikologie und Experimentelle Medizin ITEM haben eine Membran entwickelt, die bei der Heilung innerer und äußerer Wunden zum Einsatz kommen könnte. Das Team hat aus dem bioresorbierbaren Kieselgel Renacer® eine elektroversponnene Membran hergestellt, die weder zell- noch gentoxisch ist. Diese neuartige Matrix ahmt Faserstrukturen nach, die im Bindegewebe vorkommen. Sie ist vollständig biologisch abbaubar.
Ausgangspunkt der Entwicklung war ein Faservlies, das bereits zur Behandlung chronischer Wunden zugelassen ist. Dieses Vlies löst sich im Heilungsverlauf nach 6 – 8 Wochen vollständig auf. Die Forschenden haben seine Struktur nun so verändert, dass es die Faserstrukturen des Bindegewebes nachahmt und daher von körpereigenen Zellen gut angenommen wird.
Dazu hat das Forscherteam den Durchmesser der Fasern um mehr als das 50-fache verringert, sodass die Fasern nun einen Durchmesser von weniger als einem Mikrometer aufweisen. Durch die Methode des Elektrospinnens ist es dem Team gelungen, ein Kieselgelsol zu einer engmaschigen Kieselgelmembran zu verspinnen.
Während das ursprüngliche Faservlies aus 50 μm dicken Fasern von außen in eine chronische Wunde eingebracht wird, eignet sich das dünnere Faservlies auch für intraoperative Anwendungen. Ein typisches Anwendungsbeispiel wäre, Füllmaterial, das für Knochendefekte im Kiefer genutzt wird, damit abzudecken, um so die Wundheilung zu beschleunigen. Prinzipiell lässt sich die Membran im Körper mit bioabbaubaren Klebstoffen verkleben.
Was die Renacer®-Membran von herkömmlichen Produkten unterscheidet: Die offenmaschige Membran ermöglicht einen Nährstofftransport, verhindert aber trotzdem den Zelldurchtritt. Das Gewebe wird also ausreichend versorgt und der Körper kann Stoffwechselprodukte abtransportieren. Darüber hinaus ist es möglich, Wirkstoffe in die Membran zu integrieren, die freigesetzt werden, wenn sich das Vlies nach und nach auflöst.